欧洲杯压住平台与上海药物所合作揭示经典降脂药物烟酸与多种小分子激活HCAR2受体的分子机制
近日,欧洲杯压住平台段小群教授(澳门科技大学博士生导师)与中国科学院上海药物研究所段佳研究员,徐华强研究员与共同在Cell Reports杂志上发表“Molecular recognition of niacin and lipid-lowering drugs by the human hydroxycarboxylic acid receptor 2”,成功解析了烟酸(Niacin),以及临床在研的两种小分子激动剂MK-6892和GSK256073分别结合羟基羧酸受体(HCAR2)的高分辨率冷冻电镜结构,揭示了三种分子对HCAR2不同的结合模式及独特的激活机制,为开发靶向HCAR2副作用更小的降脂药物提供了重要的指导依据。
烟酸于1957年被美国批准为降血脂药物。1993年,孤儿受体GPR109A(即后来的HCAR2)被发现,2003年科学家发现GPR109A是烟酸发挥降血脂作用的受体。至今,烟酸在临床上作为降血脂药物应用已有60年的历史,在长期使用过程中,烟酸被发现可带来皮肤潮红的不良反应,从而大大地降低了病人的依从性。2010年,葛兰素史克公司研发了HCAR2的高效激动剂GSK256073,其能够有效降低甘油三酯而不引起皮肤潮红,I期临床试验展示了良好的安全性,II期临床试验表现出降脂效果。2012年,默克公司研发了另一种HCAR2的选择性高亲和力激动剂MK-6892,动物模型中展示了其可以有效降低甘油三酯而不引起显著的潮红反应。MK-6892和GSK256073代表了HCAR2激动剂药物研发的重要探索,它们与烟酸相比,显示出了对受体更高的亲和力和选择性,同时减轻了皮肤潮红等不良反应。
作为A类GPCR家族羟基羧酸受体的一员,HCAR2主要分布在人体的消化道,脾脏,脂肪组织等,与多种代谢疾病和炎症疾病相关,是一个活跃的药物研究靶点。激活HCAR2可引起下游偶联G蛋白和招募β arrestin,从而引起不同的信号传导。目前的研究表明烟酸发挥降脂功能主要是通过激活HCAR2的G蛋白通路,而动物实验表明造成不良反应潮红现象则可能是激活β arrestin通路造成的。
Niacin,MK-6892,GSK256073这三种小分子均能够有效激活HCAR2,但却能够引发不同的药理作用。三种小分子与受体发生相互作用的模式有何异同,以及小分子激活受体后引起的信号转导有何差异目前仍未可知。基于此,研究人员通过单颗粒冷冻电镜技术解析了Niacin,MK-6892,GSK256073分别结合HCAR2-Gi复合物的冷冻电镜结构,分辨率分别是3.05 Å,2.92 Å,2.80 Å。基于高质量的结构模型,研究人员揭示了三种不同分子与受体的相互作用的分子机制,并发现了三种配体虽然占用一个共同的受体正构结合口袋(Orthosteric binding pocket),但MK-6892和GSK256073的侧链还各自占据了一个长长的受体扩展口袋(Extend binding pocket),配体口袋的大小与各自的相互作用网络决定了配体与受体亲和力的强弱,也导致了三种配体在激活受体下游G蛋白通路和β arrestin通路上的差异性,这可能揭示了MK-6892和GSK256073在发挥治疗作用时能够有效避免引发皮肤潮红的原因。
在激活机制上,作者发现,三种小分子配体与控制受体激活的经典“toggle switch”残基相距甚远,进一步的结构分析与序列比对作者发现,HCAR2以及同家族的羟基羧酸受体均包含两个保守的氨基酸残基R1113.36和Y2847.43,且三种配体均与之产生明显的相互作用,突变这两个氨基酸其中的任何一个为丙氨酸,均能够导致受体失活,这进一步说明了上述两个保守的氨基酸残基在羟基羧酸受体的激活过程中发挥了至关重要的作用。有意思的是,在人体800多个GPCR成员当中,有且仅有11个GPCR在3.36位的氨基酸为精氨酸(R),这暗示了羟基羧酸受体具有相当独特的一种配体诱导受体激活的机制。
该研究成果阐明了三种小分子对 HCAR2的激活机制,为理解HCAR2的配体识别提供了结构案例,并对设计针对HCAR2受体高亲和力低副作用的药物小分子提供了结构线索。
段小群教授指导的博士生朱胜楠(欧洲杯压住平台与澳门科技大学联合培养),上海市高峰电镜中心执行主任袁青宁为本论文共同第一作者。该项工作得到国家重点研发计划、上海市市级科技重大专项、国家自然科学基金委等项目的资助。
(文、图/朱胜楠,审核/段小群)
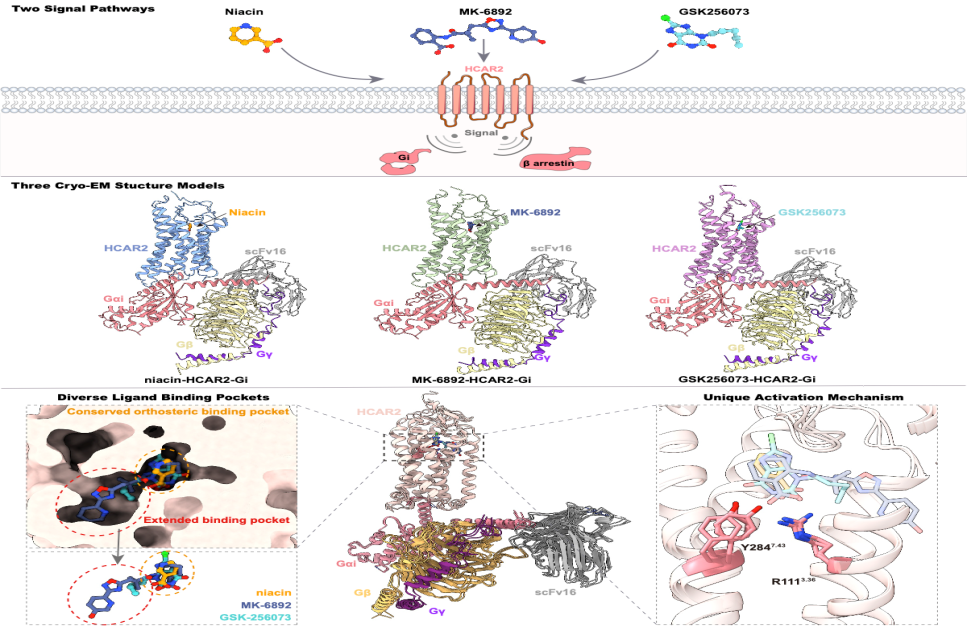
图1 经典降脂药物烟酸与多种小分子激活HCAR2受体的分子机制



